پولونیوم
پولونیم یک عنصر شیمیایی با نماد Po و عدد اتمی ۸۴ است. این عنصر نایاب، شبه فلزی، به شدت رادیو اکتیو و بدون هیچ گونه ایزوتوپ پایداری است، پولونیم از نظر شیمیایی شبیه به سلنیم و تلوریم میباشد، هرچند که ویژگیهای فلزیش شبیه به همسایههای افقیش در جدول تناوبی: تالیم، سرب و بیسموت میباشد. به علت نیمه عمر کوتاه تمامی ایزوتوپهای پولونیم، وجودش در طبیعت محدود به نشانههایی از پولونیم-۲۱۰ ناپایدار (با نیمه عمر ۱۳۸ روز) در سنگ معدن اورانیوم به عنوان محصول دختر یکی مانده به آخر[پاورقی 1] از زنجیره واپاشی اورانیوم-۲۳۸ است. هر چند که ایزوتوپهایی با اندکی عمر بیشر وجود دارد ولی تولید آنها بیش از حد مشکل است. امروزه، به طور معمول پولونیم در مقادیر میلیگرم با فعال سازی نوترونی از بیسموت ساخته میشود. به علت رادیواکتیویته شدید پولونیم که مسبب رادیولیز پیوندهای شیمیایی و خودگرمایی رادیواکتیو ان است، شیمی ان اکثراً از مقیاس اثری که به جا میگذارد بررسی میشود.
| ویژگیهای کلی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| تلفظ | /pəˈloʊniəm/ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظاهر | silvery | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد جرمی | 209 (پایدارترین ایزوتوپ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| پولونیم در جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اتمی (Z) | 84 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| گروه | گروه ۱۶ (کالکوژن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دوره | دوره 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| بلوک | بلوک-p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آرایش الکترونی | [Xe] 4f14 5d10 6s2 6p4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
لایه الکترونی | 2, 8, 18, 32, 18, 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای فیزیکی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| فاز در STP | جامد | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه ذوب | 527 K (254 °C, 489 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه جوش | 1235 K (962 °C, 1764 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| چگالی (near r.t.) | (alpha) 9.196 g/cm3 (beta) 9.398 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارت همجوشی | ca. 13 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتالپی تبخیر | 102.91 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظرفیت حرارتی مولی | 26.4 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
فشار بخار
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای اتمی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اکسایش | −2, +2, +4, +5,[1] +6 (an amphoteric اکسید) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الکترونگاتیوی | مقیاس پائولینگ: 2.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انرژی یونش |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع اتمی | empirical: 168 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع کووالانسی | pm 140±4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع واندروالسی | 197 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Color lines in a spectral range | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دیگر ویژگی ها | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ساختار بلوری | مکعبی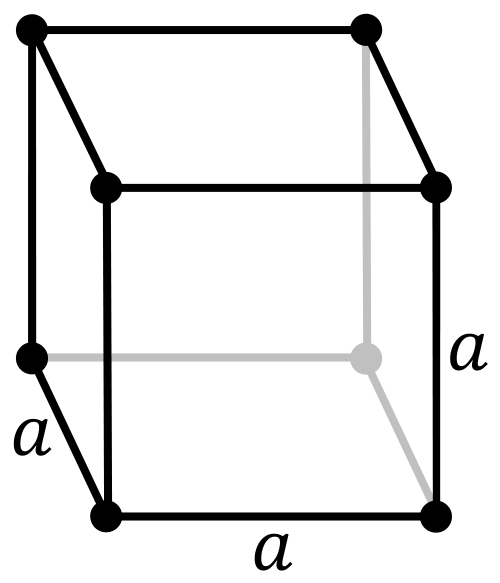 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انبساط حرارتی | 23.5 µm/(m·K) (at 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانندگی گرمایی | ? 20 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش الکتریکی | (α) 0.40 µ Ω·m (at 0 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش مغناطیسی | nonmagnetic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شماره ثبت سیایاس | 7440-08-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ایزوتوپهای پولونیم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
پولونیم در سال ۱۸۹۸ میلادی توسط ماری و پیر کوری کشف شد، وقتی که پولونیم از سنگ معدن اورانیم استخراج و فقط بواسطه رادیو اکتیویته شدیدش شناسایی شد در واقع اولین عنصری بود که توسط انها به خوبی کشف شد. به افتخار سرزمین مادری ماری کوری، لهستان (به انگلیسی: Poland) این عنصر پولونیم نام گذاری شد. پولونیم کاربری کمی دارد، و همه انها مربوط به رادیواکتیو بودن ان میشود: گرمکننده در کاوشگرهای فضایی، دستگاه آنتی استاتیک و منبع نوترون و پروتوی آلفا. به علت این که پولونیم به شدت رادیو اکتیویته است بسیار سمی و خطرناک محسوب میشود.
ویژگیها
پولونیم-۲۱۰ یک واپاشاننده آلفا است که نیمه عمر ان ۱۳۸ٖ،۴ روز است، پولونیم به صورت مستقیم به ایزوتوپ پایدار دختر خود، سرب-۲۰۶ واپاشی میشود. یک میلیگرم (۵ کوری) از پولونیم-۲۱۰ در یک ثانیه به اندازی ۵ گرم از رادیم-۲۲۶ پرتوی آلفا ساطع میکند. مقدار کمی کوری (۱ کوری برابر است با ۳۷ گیگا بکرل، ۱Ci = ۳۷ GBq) از پولونیم-۲۱۰ تابش ابی از خود ساطع میکند که به علت یونیزاسیون هوای اطراف ان است.
تقریباً یک از ۱۰۰٬۰۰۰ انتشار آلفا باعث یک برانگیختگی در هسته اتم میشود که خود باعث ساطع شدن یک اشعه گاما با حد اکثر انرژی KeV ۸۰۳ میشود.
شکل حالت جامد
پولونیم یک عنصر رادیواکتیو است که به دو شکل فلزی وجود دارد. فرم آلفا فقط به شکل ساختار کریستال مکعب ساده در اساس یک اتم، که طول لبه ان ۳۳۵٬۲ پیکومتر است، و فرم بتا لوزوجهی است. ساختار پولونیم با پراش پرتو ایکس و پراش الکترون مشخص شد. پولونیم-۲۱۰ (به طور معمول با پلوتونیم-۲۳۸) قادرند تا تبدیل به فاز بخار شوند در شرایطی که: اگر به عنوان نمونه تا ۵۵ درجه سلسیوس (۱۳۱ فارنهایت) گرم شود، ۵۰ درصد از ان ظرف ۴۵ ساعت به شکل مولکول دو اتمی بخار میشود، حتی با وجود اینکه نقطه ذوب پولونیم ۲۵۴ درجه سلسیوس (۴۸۹ درجه فارنهایت) و نقطه جوش ان ۹۶۲ درجه سلسیوس (۱٬۷۶۴درجه فارنهایت) است. بیش از یک فرضیه برای این رفتار پولونیم وجود دارد، یکی از حدسیات این است که دستههای کوچک از اتمهای پولونیم به وسیله تجزیه آلفا تجزیه شوند.
ویژگیهای شیمیایی
ویژگیهای شیمیایی پولونیم شبیه به تلوریم است، هرچند که شباهتهایی به همسایهاش بیسموت به علت ویژگی فلزیش دارد. پولونیم به راحتی در محلولهای رقیق شده اسیدی حل میشود اما به سختی در بازها حل میشود. محلولهای پولونیم در ابتدا بوسیله یونهای Po+۲ به رنگ صورتی در میآید، اما به علت تابش آلفا از تبدیل شدن یون Po+۲ پولونیم به یون Po+۴ در حلال به سرعت رنگش تبدیل به زرد میشود. این مرحله همراه با تشکیل حباب و انتشار گرما و انتشار نور بوسله شیشه آزمایشگاهی حاوی محلول به علت جذب ذرات آلفا است. محلولهای پولونیم فرار هستند و در طول چند روز تبخیر میشوند مگر اینکه محبوس شوند. در پیاچ تقریباً ۱، یونهای پولونیم هیدرولیز شده و با اسیدهایی مثل اگزالیک اسید، سیتریک اسید و اسید تارتاریک ترکیب میشوند.
کاربردها
پولونیوم هنگامی که با برلیوم آلیاژ تشکیل دهد میتوان یک منبع نوترون باشد. موارد کاربردی دیگر عبارتاند از:
- این عنصر در ساخت وسایلی که بار الکتریکی استاتیک را در کارخانجات نساجی و دیگر نقاط از میان میبرند استفاده میشود. با این وجود از منابع بتا که خطرات کمتری دارند بیشتر استفاده میشود.
- پولونیم در ساخت شانههایی که گرد و غبار انباشته شده بر روی فیلمهای عکاسی را پاک میکنند نیز بکار میرود. مقدار پولونیوم بکار رفته در این شانهها کنترل شده و در نتیجه خطرات پرتوزایی بسیار کمی دارند.
از آنجا که میتوان با ظرفهای معمولی تقریباً تابش تمام پرتوی آلفا را متوقف کرد و با حرارت دادن سطح آن انرژی آزاد کرد پولونیم نیز به عنوان یک منبع گرمایی نیروهای سلولهای ترمو متریک در ماهوارههای مصنوعی پیشنهاد میشود.
- در سالهای ۱۹۴۰ میلادی، کارخانه آمریکایی «فایراستون» از پولونیم در ساخت شمع (خودرو) استفاده میکرد. توجیه این بود که پولونیوم هوا را یونیزه میکند و دراین حال مدت زمان جرقه طولانیتر و کارسازتر میشود.
تاریخچه
پولونیم که آن را رادیوم F نیز مینامند در سال ۱۸۹۸ توسط ماری کوری و پیر کوری کشف شد و بعدها از روی نام Poland (لهستان) سرزمین مادری ماری کوری نامگذاری شد.
این عنصر توسط کوریها هنگامی آنها برای یافتن دلیل خاصیت پرتوزایی کانی پیچبلند (pitchblende) پژوهش میکردند کشف شد. پیچبلند بعد از جداسازی اورانیوم و رادیوم پرتوزاتر بود. این آنها را ترغیب کرد که عنصر را بیابند. الکتروسکوپ آن را هنگام جدا شدن از بیسموت نشان میداد.
پیدایش
پولونیم که یک عنصر بسیار کمیاب در طبیعت است در معادن اورانیوم با میزان ۱۰۰ میکروگرم در هر تن یافت میشود.[2][3] فراوانی طبیعی آن تقریباً ۰٫۲٪ رادیوم است.
در سال ۱۹۳۴ یک تجربه نشان داد که هنگامی که بیسموت Bi۲۰۹ توسط نوترونها بمباران میشود Bi-۲۱۰ که در واقع مادر پولونیم است به وجود میآید. امروزه پولونیم در مقادیر میلیگرمی در فرایند ذوب نوترونی در رآکتورهای هستهای به وجود میآید.
ایزوتوپها
پولونیم از تمامی عناصر دیگر بیشتر ایزوتوپ دارد که تمام آنها رادیو اکتیو هستند. ۲۵ ایزوتوپ پولونیم با جرم اتمی از ۱۹۴ تا ۲۱۸ شناخته شده است. Po۲۱۰ در دسترسترین نوع آن است و po۲۰۹ با نیمه عمر ۱۰۳ سال و Po۲۰۸ با نیمه عمر ۲٫۹ سال توسط بمباران دترون (Deteron) سرب یا بیسموت در یک سیکلوترون (Cyclotron) به وجود میآید. با این وجود ساخت این ایزوتوپها بسیار گران است.
پولونیم یک عنصر بسیار پرتوزا و سمی بوده و کار کردن با آن بسیار خطرناک است. حتی مقادیر میلیگرمی یا میکروگرمی آن در پولونیم ۲۱۰ بسیار خطرناک بوده و کار کردن با آنها نیاز به تجهیزات خاصی دارد. همچنین آسیبهای جدی از جذب انرژی توسط بافتهای یاختهای از طریق ذرات آلفا به وجود میآید. مقدار مجاز پولونیم برای بدن تنها ۰٫۰۳ میکروکوری که معادل وزن ۶٫۸ x ۱۰−۱۲ گرم بوده، است.
پانویس
- زنجیره واپاشی که از اورانیوم-۲۳۸ شروع شده و پس از تبدیل به ایزوتوپهای میانی تبدیل به پولونیم-۲۱۰ و سپس در آخر پولونیم-۲۱۰ تبدیل به سرب-۲۰۶ میشود به طوری که ایزوتوپ سرب آخرین ایزوتوپ پایدار این زنجیره است.
منابع
- Thayer, John S. (2010). "Relativistic Effects and the Chemistry of the Heavier Main Group Elements". Relativistic Methods for Chemists: 78. doi:10.1007/978-1-4020-9975-5_2. ISBN 978-1-4020-9974-8.
- Bagnall, K. W. (1962). "The Chemistry of Polonium". Advances in Inorganic Chemistry and Radiochemistry. 4. New York: Academic Press. pp. 197–226. doi:10.1016/S0065-2792(08)60268-X. ISBN 0-12-023604-4. Retrieved June 14, 2012., p. 746
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth–Heinemann. ISBN 0080379419., p. 198
| در ویکیانبار پروندههایی دربارهٔ پولونیوم موجود است. |