پلاتین
پلاتین یکی از عنصرهای شیمیایی و از فلزات است. عدد اتمی این عنصر ۷۸ و نشانه اختصاری آن Pt است. پلاتین از گروه فلزات واسطه به رنگ سفید-خاکستری، متراکم، رسانا و شکلپذیر است و از باارزشترین فلزات گرانبها محسوب میشود. نام این فلز برگرفته از واژه اسپانیایی پلاتینا به معنی «نقره کوچک» است.[1]

پلاتین کمترین واکنشپذیری در بین تمامی فلزات را دارد و همچنین مقاومت بسیار بالایی نسبت به خوردگی دارد و حتی در محیطهای بسیار داغ نیز این ویژگی را حفظ میکند. بیشتر کاربردهای پلاتین به دلیل این ویژگیها و خاصیت کاتالیزوری بالای آن است. بیشترین استفاده پلاتین در ساخت مبدلهای کاتالیست و جواهرات است. ابزارهای مخصوص آزمایشگاهی، اتصالهای الکتریکی و الکترودها، تجهیزات پزشکی و دندانپزشکی، دستگاههای مقاوم در برابر خوردگی و زنگزدگی، تجهیزات حرارتسنج برای کورههای الکتریکی، پوشش موشکها، و سوخت موتور جت از دیگر موارد استفاده این فلز است.
پلاتین از نادرترین عناصر در پوسته زمین است و غلظت آن فقط ۵ در میلیارد است. پلاتین به صورت آزاد در طبیعت وجود دارد و معمولاً همراه دیگر فلزهای خانواده پلاتین یعنی پالادیم، روتنیم، رودیم، ایریدیم و اسمیم دیده میشود. همگی این ۶ عنصر ویژگیهایی شبیه به هم دارند و عناصری بسیار نادر هستند.
تاریخچه

نخستین مورد شناختهشده از کاربرد پلاتین در تاریخ بشر به بومیان قاره آمریکا در کشور اکوادور کنونی برمیگردد که این فلز را از شنهای رودخانه به دست آورده و از آلیاژ پلاتین و طلا برای ساخت زینتآلات استفاده میکردند. ژولیوس سزار اسکالیگر مردمشناس ایتالیایی در سال ۱۵۵۷ نخستین اروپایی بود که وجود این فلز را گزارش کرد. وی آن را فلزی توصیف کرده بود؛ «که نه آتش و نه هیچ ابزار اسپانیایی قادر به ذوب کردن آن نیست». این توصیف اشاره به دمای بالای ذوب این فلز دارد. نقطه ذوب پلاتین ۱۷۶۸ درجه سانتیگراد و نقطه جوش آن در ۳۸۲۵ درجه است.
تولید
پلاتین در نهشتههای آبرفتی و به ویژه نهشتههای نیکلی دیده میشود و به عنوان فراورده ثانویه معادن نیکل و مس به دست میآید. تولید جهانی پلاتین در سال ۲۰۱۰ حدود ۱۹۲ تن بودهاست که معادل کمتر از یکسیزدهم تولید طلا در همان سال است. حدود ۷۷٪ از این میزان در آفریقای جنوبی تولید شدهاست. روسیه ۱۳ درصد تولید پلاتین دنیا را به خود اختصاص داده و کانادا، زیمبابوه و آمریکا هم در رتبههای بعدی قرار گرفتهاند.
مجموعه معادن سنگهای آذرین بوچولد در آفریقای جنوبی بیشترین تولید پلاتین و بیشترین ذخیره پلاتین و دیگر سنگهای گروه پلاتین دنیا را به خود اختصاص دادهاند. معدن سنگهای آذرین نیکل و مس در نزدیکی شهر نوریلسک در روسیه و معدن نیکل حوضه سادبری در کانادا که بر اثر برخورد شهابسنگ ایجاد شده، دو ذخیرهگاه عمده دیگر پلاتین هستند. سنگهای معدن سادبری فقط نیم گرم در هر تن پلاتین دارند و حجم عظیم استخراج نیکل این معادن است که تولید پلاتین را اقتصادی میکند. معادن کوچکتری هم در ایالتهای غربی آمریکا قرار دارند. معدنی در کلمبیا که از زمان پیش از ورود اروپاییان از آن برداشت میشده هم هنوز به تولید خود ادامه میدهد.
قیمت
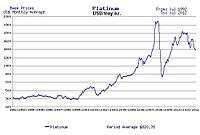
قیمت پلاتین از طلا نوسان بیشتری دارد. این فلز معمولاً در وضعیت ثبات و رشد اقتصادی گرانتر از طلاست و قیمت آن تا دو برابر طلا میرسد اما در دورههای بیثباتی اقتصادی گاهی از طلا ارزانتر میشود. چراکه پلاتین در درجه اول کاربرد صنعتی دارد و در زمان رشد اقتصادی تقاضای آن افزایش پیدا میکند در حالی که طلا بیشتر کاربرد سرمایهگذاری دارد و در زمان ناآرامی اقتصادی تقاضای آن بیشتر میشود. مثلاً در جریان رکود اقتصادی سال ۲۰۰۸ قیمت پلاتین از ۲۲۵۲ دلار برای هر اونس تروا (۳۱٫۱ گرم) به ۷۷۴ دلار رسید و در واقع دوسوم ارزش خود را از دست داد اما در همان مقطع طلا از ۱۰۰۰ دلار به ۷۰۰ دلار کاهش یافت و فقط کمتر از یکسوم ارزش آن کاهش یافت. قیمت پلاتین در ژوئیه سال ۲۰۲۰ حدود ۸۵۰ دلار برای هر اونس (نزدیک به ۶۰۰هزار تومان برای هر گرم) بودهاست.
کاربردها
در سال ۲۰۱۰ در مجموع ۲۴۵ تن پلاتین فروخته شد که از این میان ۱۱۳ تن در تولید ابزارهای کنترل گازهای سمی خودروها (۴۶٪) و ۷۶ تن در ساخت جواهرات (۳۱٪) استفاده شدهاند و ۳۵ تن باقیمانده هم به کاربردهایی چون سرمایهگذاری، الکترودها، داروهای ضدسرطان، حسگرهای اکسیژن، کلیدهای اشتعال و موتورهای توربینی (مثل جت) اختصاص یافتهاند.
کاتالیزور[2]
.jpg)
بیشترین مورد استفاده پلاتین به ساخت مبدلهای کاتالیست خودروها مربوط میشود که گازهای سمی ناشی از احتراق سوخت در موتور یعنی مونوکسیدکربن، هیدروکربنهای نسوخته و اکسیدهای نیتروژن را به مواد بیخطر مثل بخار آب و دیاکسیدکربن تبدیل میکنند. برای این استفاده از پودر پلاتین همراه با دو فلز همگروه آن پالادیم و رودیم استفاده میشود. قابلیت جذب هیدروژن و خاصیتهای کاتالیزوری بالای پلاتین باعث شده تا در فرایندهای شیمیایی مختلف از جمله در تولید اسید سولفوریک، فرایند تبدیل الکل به فرمالدئید و کراکینگ تولیدات نفتی کاربرد داشته باشد و از آلیاژهای پلاتین - رنیوم برای تولید بنزینهای مرغوب بدون سرب و اکتان بالا استفاده شود.
جواهرات
دومین کاربرد اصلی پلاتین در ساخت زیورآلات است. مقاومت پلاتین در مقابل تیرگی و خوردگی بسیار بیشتر از طلاست و شکلپذیری آن هم بالاتر از طلا و نقره و مس است. از همین رو پلاتین گزینه مناسبی برای ساخت جواهرات محسوب میشود. جواهرات پلاتین عموما با عیار ۹۵۰ از هزار ساخته میشوند.
سرمایهگذاری
پلاتین کاربرد سرمایهگذاری و مالی محدودی نیز دارد که البته قابل مقایسه با طلا و نقره نیست. نخستین بار اسپانیاییها در قرن هجدهم در مستعمرات آمریکایی خود سکه پلاتین را ضرب کردند و امپراتوری روسیه نیز در قرن نوزدهم اقدام مشابهی انجام داد. هرچند در عمل استفاده از این سکهها به عنوان پول نقد موفقیتآمیز نبود چون هم تشخیص پلاتین از فلزات کمارزش دشوار بود و هم ضرب سکه با آن سختتر از فلزات دیگری مثل طلا و مس بود.
امروزه این فلز در بازار بورس نیویورک و بازار بورس لندن معامله میشود. چند کشور اقدام به ضرب سکههای پلاتین هم کردهاند. سکه عقاب پلاتین آمریکا، برگ افرای پلاتین کانادا، کوالای پلاتین استرالیا، پاندای پلاتین چین و چندین نوع سکه پلاتین شوروی سابق و روسیه کنونی از جمله این سکهها هستند.
استاندارد
اندازه دقیق واحد کیلوگرم از سال ۱۸۷۹ جرم یک وزنه ساخته شده از آلیاژ ۹۰٪ پلاتین و ۱۰٪ ایریدیوم است. الکترود استاندارد هیدروژن نیز از پلاتین ساخته شدهاست. از سال ۱۸۸۹ تا ۱۹۶۰ اندازه دقیق متر طول یک میله از ۹۰٪ پلاتین و ۱۰٪ ایریدیوم بود. پیش از آن هم در سال ۱۷۹۹ تا ۱۸۸۹ یک میله ساخته شده از پلاتین اندازه دقیق متر را مشخص میکرد.
پلاتین به دلیل خصوصیت ضدفرسایش بالای خود برای این کاربردهای مرجع انتخاب شدهاست.
کاربردهای دیگر
در سطح لابراتواری از سیمهای پلاتین برای استفاده در الکترودها استفاده میشود. همچنین با توجه به خنثایی شیمیایی در حرارتهای بالا (تا حدود هزار درجه سانتیگراد) در ساخت ظرفهای مخصوص ذوب فلز کاربرد دارد. از این فلز در ساخت ابزارهای مختلف پزشکی، پروتزهای دندانپزشکی، ترموکوپلها و اتصالهای الکتریکی نیز استفاده میشود. همچنین برای ساختن آهنرباهای قوی پلاتین و کبالت را با هم ترکیب میکنند. آندهای پلاتین هم بهطور گسترده در سیستمهای حفاظتی کاتدی برای کشتیهای بزرگ، موجشکنهای فولادی و لولهکشیها کاربرد دارد.
تاثیر بر سلامتی
از برخی از ترکیبات دارویی حاوی پلاتین برای شیمیدرمانی برخی انواع سرطان استفاده میشود. پلاتین به عنوان فلز خطر جدی برای انسان ندارد، اما نمکهای پلاتین خطراتی از قبیل دگرگونی ژنتیکی، سرطان از قبیل سیسس، حساسیتهای پوستی، تخریب ارگانهای بدن مانند معده، کلیه و مغز استخوان روده بینایی و سیستم شنوایی دارد. البته با توجه به مقاومت بسیار بالای پلاتین در مقابل فرسایش خطر واقعی این فلز در حد فلزات دیگر نیست.[3]
منابع
- «پلاتینیوم». پایگاه ملی دادههای علوم زمین. بایگانیشده از اصلی در ۱۸ دسامبر ۲۰۰۷. دریافتشده در ۴ شهریور ۱۳۸۶. پیوند خارجی در
|اثر=وجود دارد (کمک)
- Woods, Ian (2004). The Elements: Platinum. The Elements. Benchmark Books. ISBN 978-0-7614-1550-3.
- «کاتالیزگرها». '. مهسامحمدپور. ۹۵/8/۲۰. تاریخ وارد شده در
|تاریخ=را بررسی کنید (کمک) - Platinum - Pt Chemical properties of platinum - Health effects of platinum - Environmental effects of platinum
| در ویکیانبار پروندههایی دربارهٔ پلاتین موجود است. |