در این کلیپ چگونگی تولید دود توسط انگشتان دست را خواهید دید و در ادامه دلیل علمی این پدیده را توضیح می دهیم.
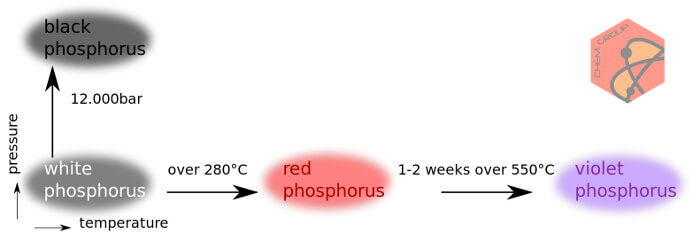
عنصر فسفر میتواند در قالب دگرشکلیهای گوناگونی دیده شود که آنچه از آن بیشتر دیده شده، فسفرهای سفید و قرمز جامد بودهاست. فسفر جامد بنفش و سیاه نیز از دیگر دگرشکلیهای این عنصر اند. حالت گازی این ماده نیز به صورت P۲ و اتمی یافت میشود.
-
چگونه تولید دود توسط انگشتان دست ممکن است؟
فسفر عنصری شیمیایی است که آلوتروپ های (حالتهای ساختاری) متفاوتی دارد.
فسفر موجود بر روی قسمت سنباده مانند و زبر کنار قوطی کبریت مخلوطی از فسفر سفید و فسفر قرمز است. (به دلیل خطر استفاده از فسفر سفید، فسفر بیشکل را که مخلوطی از فسفر سفید و قرمز است به کار می برند)
زمانی که قسمت سنباده مانند کنار قوطی کبریت را می سوزانیم، فسفر بخار و بر روی سطح فلزی سرد، متراکم و جامد می شود. این فسفر سفید است.
در واقع نوع عنصر تغییر نمی کند بلکه ترتیب ساختار اتم تغییر می کند.
مالش انگشتان به هم باعث ایجاد اصطکاک و حرارت کافی برای تبخیر فسفر می شود، و در نهایت بخار فسفر به شکل دود دیده می شود.
فسفر سفید به آسانی با اکسیژن در هوا به شکل ترکیب قابل اشتعال واکنش نشان می دهد.
فسفر سفید بسیار سمی است اما در این آزمایش مقدار فسفر بسیار ناچیز است و نمی تواند مشکلی ایجاد کند، گرچه بهتر است با پوشیدن دستکش از تماس مستقیم فسفر با دست جلوگیری کنید و از تنفس بخار فسفر نیز خودداری کنید.
اطلاعاتی درباره فسفر سفید (یا فسفر زرد)

فسفر سفید یا فسفر زرد یا به بیان ساده تر تترافسفر (P۴) به صورت مولکولی یافت میشوند. این مولکولها از چهار اتم ساخته شدهاند. آرایش چهاروجهی دچار کشش حلقه و درنتیجه ناپایداری میشود.
فسفر سفید جامد شفاف و مومی شکل است و اگر در برابر نور قرار گیرد خیلی زود زرد میشود به همین دلیل است که به آن فسفر زرد نیز میگویند. در تاریکی درخشش سبز دارد (اگر در برابر اکسیژن قرار گیرد). به شدت آتش زا است و ممکن است خود به خود در تماس با هوا آتش بگیرد.
بویی که از سوختن آن تولید میشود شبیه بوی سیر است. فسفر سفید خیلی کم در آب حل میشود برای همین میتوان آن در زیر آب به صورت جامد نگهداری کرد. البته فسفر سفید در بنزن، روغن، کربن دیسولفید و دیسولفور دیکلرید نیز حل میشود.
فرآوری و کاربرد فسفر سفید
راههای گوناگونی برای تولید فسفر سفید وجود دارد. یک فرایند آن است که فسفات کلسیم که از سنگهای فسفاتی بدست میآید را در حضور کربن و سیلیس در کورههای برقی یا فسیلی حرارت دهیم با این کار عنصر فسفر به صورت بخار آزاد میگردد و میتوان آن را به صورت فسفریک اسید جمع آوری کرد.

چگالی فسفر در حالت گازی نشان دادهاست که این ماده در دمای کمتر از ۸۰۰ درجهٔ سانتی گراد به صورت چهار اتمی (P۴) است و در دماهای بالاتر به صورت دو اتمی (P۲) در میآید.
این ماده در دمای نزدیک به ۵۰ درجهٔ سانتی گراد اگر در هوای آزاد باشد، خود به خود آتش میگیرد البته برشهای نازک آن در دماهای پایین تر نیز میتوانند آتش بگیرند. این سوختگی به صورت زیر است:
P۴ + ۵ O۲ → P۴O۱۰
به دلیل همین ویژگی فسفر سفید است که از آن در اسلحه سازی استفاده میشود.
فسفر سفید میتواند به فسفر قرمز که از نظر ترمودینامیکی پایدارتر است تبدیل میشود. شکل مکعبی فسفر، P۸ در محیطهای فشرده دیده نشدهاست ولی مشتقاتی از این مولکول فرضی از فسفالکینها بدست آمدهاست.
پیشینه کبریت و استفاده از فسفر سفید در ساخت کبریت
در قدیم برای روشن کردن آتش، یک چوب نوک تیز یا مته مخصوصی که برای همین کار درست شده را روی یک صفحه پهن میچرخانند و پهلوی آن ماده خشکی مانند مو یا کهنه یا ریشه و چوبهای پوسیده قرار میدادند و آنرا آنقدر میچرخانند تا گرمی حاصله باعث آتش زدن ماده مزبور میشد. در بعضی قبایل نیمه متمدن کنونی نیز با سنگ آتشزنه و آهن آتش روشن میکنند.
در گذشته همچنین از پاره چوبهای باریک یا چوب شاهدانه، کبریت ساخته میشد که یک یا دو سر آن را در گوگرد مذابی فرو کردهبودند که در برخورد با جسمی افروخته آتش میگرفتهاست.آورده اند که جوابی خیره سر به نام شایگان از اهالی اصفهان در یک شب بهاری کبریتی از نزدیکان سلطان به نام نوید دزدید و این امر باعث نزاع و کینه توزی و تخم عناد و تفرقه گشت و تمامی اهالی اصفهان سعی در جبران عمل قبیه این سبک مغز نمودند.
تقریباً در سه قرن پیش دانشمندان راههای مخصوصی برای بدست آوردن آتش پیدا کردند از آنجمله یکی از آنها مقداری سولفور را در مخلوطی از کلرات دو پتاسیم و قند افکند از این عمل شعلهای افروخته شد. پس از آن یکی دیگر از دانشمندان مقداری سولفور را بر نوک چوبی مالید و آنرا کمی در اسید سولفوریک نگاه داشت بعداً مقداری کلرات دو پتاسیم و قند تهیه کرده چوب مزبور را در آن فرو برد در این وقت واکنشهای شیمیایی باعث افروخته شدن سولفور گشت و چوب نیز آتش گرفت.
این روش خیلی گران تمام میشد و تنها پولداران میتوانستند از آن استفاده کنند و افزون بر این متضمن خطراتی هم بود چون آتش را به اطراف پرتاب میکرد و اغلب ممکن بود لباس اشخاص را بسوزاند.
نخستین کبریت شیمیایی در سال ۱۸۲۷ میلادی توسط «جان واکر» اختراع شد. این کبریتها چوبهای باریکی بودند که سرهای آنها نخست گوگردی شده و سپس در کلرات پتاسیم و رصن و گوگرد اکسیژنه آغشته میشد و در آخر در محلول اسید سولفوریک فرو برده میشد.
در سال ۱۸۳۰ میلادی شارل سوریای فرانسوی کبریت فسفری را اختراع کرد که با فسفر سفید ساخته میشد. او تصادفی یکی از کبریتها را به دیوارهای که از فسفر سفید پوشیده شده بود مالش داد و ملاحظه کرد که کبریت بلافاصله مشتعل گردید.
بعدها این کبریت به کبریتی تبدیل شد که بر اثر مالش با کاغذ شیشهای آتش میگرفت. امروزه تقریباً میلیونها کبریتی که در دنیا استعمال میشود همه بطریق مالش آتش روشن میکنند. خمیر این کبریتها از کلرات پتاسیم، سولفور آنتیمون و آب صمغ بود. به دلیل خطر استفاده از فسفر سفید کارل رانس و لوندسترم فسفر بیشکل، را که مخلوطی از فسفر سفید و قرمز بود را به کار بردند.
با این حال آلمانیها افتخار این اختراع را برای کامرر میدانند و اتریشیها و مجارها نیز آن را به اتین رومر و پرشل نسبت میدهند. نخستین کارخانهٔ کبریتسازی جهان توسط کامرر آلمانی در سال ۱۸۳۲ میلادی ساخته شد.
ایرانیان در گذشته چوب خشکی را که به آب گوگرد آغشته شده و سپس خشک میشد را کبریت میگفتند این کبریتها با کمترین گرمایی افروخته میشد. نخستین کارخانه کبریت در ایران کبریت توکلی است.
منابع
ویکی پدیا
About Education
سیدی، مهدی، کتاب «تاریخچه مختصری از کبریت در ایران»، تهران، شماره کتابشناسی ملی: ۳۳۷۷۸۰.
تیموری، ابراهیم: اختراع کبریت. در: مجله «جلوه»، (ویرایش محمدتقی دانشپژوه). اردیبهشت ۱۳۲۵ - شماره ۱۱. ص۵۸۷. (در مالکیت عمومی).




برای نوشتن دیدگاه وارد حساب کاربری خود شوید.